
结直肠癌 (CRC) 类器官
患者源性结直肠癌类器官
结直肠癌患者来源类器官 (PDO) 是可复制 CRC 患者肠上皮生理学和遗传特征的三维 (3D) 细胞培养模型。这些 CRC PDO 模型可以模拟细胞间相互作用以及氧气和营养物质流入肿瘤微环境的过程。在实验室中培养时,这些肿瘤类器官可作为 3D 肿瘤的多细胞微型复制品,并证明其具有保留体内特征的能力。
CRC 类器官(以及体内其他器官的类器官)来源于从患者活检组织中分离的成体干细胞。该组织在实验室进行处理,并包埋在提供物理支持和生长因子的凝胶状基底膜基质中。组织内的干细胞分裂形成多种细胞类型(包括更多的干细胞),这些细胞可自组装成模拟原始肿瘤细胞的结构构象和生理学的三维结构。这些结构在形成后可以分开,重新接种多个以同样方式自组装的新 PDO。如此便可根据需要扩大类器官的数量,以提供更多类器官。
结直肠癌患者源性类器官的优势
CRC 相关基因改变和肿瘤组成的表现使得 CRC PDO 非常适用于癌症研究和药物发现。生物学相关的 CRC PDO 可表现出与患者相似的药物反应,说明其在预测新型疗法的有效性方面具有价值。然而,传统手动类器官检测工作流程不适合用于药物发现的可重复高通量化合物筛选。
类器官扩展和检测自动化的进展有助于标准化 CRC PDO 工作流程。我们的 3D Ready类器官是在工业环境中使用我们专有的生物反应器技术和严格控制的工艺制造的类器官。目前单个批次就可生成数百万个标准化、大小一致且经过质量测试的类器官。CRC 类器官以冷冻方式保存,可以在需要时用于高通量测定。通过液体处理将 PDO 接种到多孔培养皿中并用化合物处理,可显著减少错误并缩短实际操作时间。可以通过适当检测和成像分析来评估药物处理时的变化。
结直肠癌肿瘤类器官的培养和检测工作流程
可自动化评估药物对结直肠肿瘤类器官的效应。以下工作流程描述了抗癌化合物效应的自动化评估。通过使用生物反应器技术在生物工艺中扩增可扩大 PDO 规模。用供试药物处理类器官后,使用 ImageXpress® Micro 共聚焦高内涵成像系统进行形态分析,并使用SpectraMax® iD5 多功能微孔板读板机进行活性检测。工作流程包括自动化孵育和液体处理,以及将培养板从培养箱转移到液体处理器和读板机的调度软件。

CRC PDO 实验方案
- 类器官生物工艺 -手动扩增 CRC PDO 并将其接种到生物反应器中。对得到的类器官进行计数和评估,以确定其最终大小范围。将规定数量的类器官置于小瓶中冷冻保存,以便用户方便时即可进行检测。
- 解冻 - PDO 在 37°C 下用新鲜培养基进行解冻,待其形成颗粒。
- 接种 - 将 PDO 悬浮在所需的水凝胶或基底膜基质中,以按所需的密度接种到多孔板。
- 处理 - 在接种后 48 小时,对孔中的 PDO 应用所需浓度的供试化合物或药物进行处理。
- 成像和分析 - 在化合物处理五天后进行透射光 (TL) 成像,以确定所需的参数,如类器官数量、平均直径、平均体积、类器官覆盖的总面积、形态等。
- 活性检测 – 终点检测方案示例
- 活性检测试剂 - 使用自动化液体处理器将检测试剂添加到孔中以进行发光三磷酸腺苷 (ATP) 细胞活性检测,同时自动化微孔板振摇可介导细胞裂解。
- 孵育 - 在室温下孵育 25 分钟。
- 发光 ATP 细胞活性检测 - 使用调度软件和样品处理器将微孔板从培养箱转移至液体处理器和微孔板读板机。使用微孔板读板机读取数据和数据分析软件对结果进行分析。
我们针对定制的结直肠类器官工作流程提供广泛的实验室自动化解决方案。从类器官培养和接种到液体处理和图像采集的每个步骤都可以实现自动化,并与我们的数据分析软件解决方案相结合,方便您的类器官检测生成符合法规和随时可供发表的报告。
特色专题
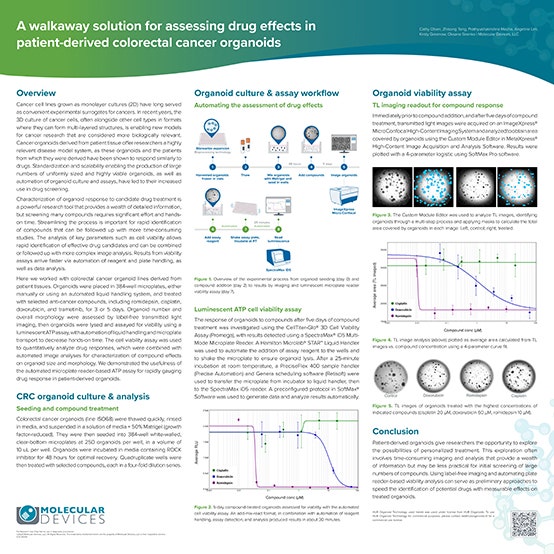
用于评估患者源性结直肠癌类器官中的药物作用的无人值守解决方案
在本科学海报中,患者源性结直肠癌类器官用抗癌化合物罗米地辛、顺铂、多柔比星和曲美替尼进行培养和处理。
非标记透射光成像显示类器官数量和类器官覆盖的总面积在药物治疗后出现剂量依赖性变化。基于读板机的发光 ATP 检测有助于从类器官中收集定量细胞活性数据。
工作流程涉及使用自动化液体处理、微孔板转移和软件分析方法,以缩短实际操作时间并加快药物筛选。
前沿资源
结直肠类器官结构的复杂性需要先进的成像和分析策略。此外,自动执行耗时费力的步骤,可以加快周转并提高一致性。了解如何通过自动化策略实现定性和定量高通量进行肿瘤类器官分析。